 Cadeias carbônicas
Cadeias carbônicas
Cadeia carbônica é toda estrutura formada por átomos de carbono ligados entre si. Os elementos mais comuns nas cadeias carbônicas são:
Carbono: é tetravalente e efetua sempre quatro ligações, que são representadas por traços ao seu redor. Apesar de poder fazer até quatro ligações, com um mesmo átomo ele pode efetuar somente três.
Hidrogênio: é monovalente e efetua somente uma ligação, que é representada por um traço.
Oxigênio: é divalente e efetua duas ligações, que são representadas por dois traços. Pode se ligar a dois átomos ao mesmo tempo ou efetuar suas duas ligações com o mesmo átomo.
Nitrogênio: é trivalente e efetua três ligações, que são representadas por três traços. Pode se ligar a dois ou três átomos ao mesmo tempo, ou ainda, efetuar suas três ligações com o mesmo átomo.
As cadeias orgânicas podem ser representadas de maneira simplificada. Neste tipo representação, os traços das ligações com os átomos de hidrogênio são omitidas.
H H H
| | |
H - C - C - C - H H3C - CH2 - CH3
| | |
H H H
representação convencional representação simplificada
Os átomos de carbono das cadeias podem ser classificados de acordo com o número de outros carbonos a que se encontrem ligados.
Carbono primário: ligado a somente um outro átomo de carbono.
Carbono secundário: ligado a dois outros átomos de carbono.
Carbono terciário: ligado a três outros átomos de carbono.
Carbono quaternário: ligado a quatro outros átomos de carbono.
Para este tipo de classificação não se considera se a ligação entre os carbonos é simples, dupla ou tripla, somente o número de carbonos a que se encontra ligado.
CH3 CH3
| |
H3C - C - CH2 - C = CH2
|
CH3
C carbono primário
C carbono secundário
C carbono terciário
C carbono quaternário
classificações das cadeias carbônicas
As cadeias orgânicas podem ser divididas em três grupos:
abertas, acíclicas ou alifáticas: a cadeia não se fecha em nenhum ponto
H3C - CH2 - CH2 - CH3
fechadas ou cíclicas: a cadeia se fecha, formando uma figura geométrica
H2C - CH2
| |
H2C - CH2
mistas: presença de cadeia fechada e pelo menos um carbono fora do anel
H2C - CH - CH2 - CH3
| |
H2C - CH2
Estes tipos de cadeias podem ainda acumular outras classificações:
Cadeia saturada / insaturada
Na cadeia saturada ocorrem somente ligações simples entre os átomos de carbono.
Na cadeia insaturada ocorre dupla e/ou tripla ligação entre átomos de carbono. É bom lembrar que quando ocorre ligação dupla ou tripla entre carbono e outro elemento, esta não é considerada para classificar a cadeia como insaturada.
H3C - CH2 - CH2 - CH3 H3C - CH2 - CH = O H3C - CH2 - CH = CH2
cadeia saturada cadeia saturada cadeia insaturada
Cadeia normal / ramificada
Na cadeia normal não ocorrem "ramos" ou "galhos", os carbonos são todos primários e secundários. A cadeia tem um só eixo.
Na cadeia ramificada ocorrem os "ramos" ou "galhos", deve ocorrer pelo menos um carbono terciário ou quaternário. A cadeia tem pelos menos dois eixos.
CH3 CH3
| |
H3C - C - CH2 - C = CH2
|
CH3
Nas posições em que ocorrem carbonos terciário (C) ou quaternário (C) a cadeia tem dois eixos, o que a caracteriza como ramificada. A cadeia abaixo é não ramificada, pois como ela não possui carbono terciário ou quaternário, poderia ser escrita em um só eixo (linear).
H3C - CH2 - CH2 - CH2 H3C - CH2 - CH2 - CH2 - CH3
|
CH3
Cadeia homogênea / heterogênea
Na cadeia homogênea a sequência de carbonos ocorre sem interrupção de um átomo diferente. Na cadeia heterogênea existe um átomo diferente do de carbono que interrompe a seqüência de carbonos. Para funcionar como heteroátomo, este deve ser, no mínimo, divalente.
H3C - CH2 - CH2 - O - CH2 - CH3 H3C - CH2 - CH2 - CH2 - CH = O
cadeia heterogênea cadeia homogênea
Átomo diferente do de carbono no final da seqüência de carbonos não é heteroátomo.
Cadeia homogênea e cíclica é dita homocíclica. Cadeia heterogênea e cíclica é dita heterocíclica.
H2C - CH2 H2C - O
| | | |
H2C - CH2 H2C - CH2
cadeia homocíclica cadeia heterocíclica
Presença ou não do benzeno
A estrutura do benzeno (C6H6) é extremamente importante em química orgânica. É um ciclo de seis carbonos contendo três duplas ligações intercaladas. Pode aparecer de duas formas:
 ou
ou 
O círculo no interior do hexágono indica que as duplas ligações encontram-se em constante movimentação.
A cadeia aromática possui o benzeno na sua estrutura. Quando a estrutura possui mais de um núcleo de benzeno, ela é chamada depolinuclear. Se dois átomos de carbono participam simultaneamente dos dois anéis, a estrutura é chamada de polinuclear condensada.
Quando não há nenhum átomo de carbono em comum entre os núcleos, a estrutura é chamada de polinuclear de núcleos isolados.
A alicíclica é qualquer cadeia cíclica que não apresente o benzeno na sua estrutura.





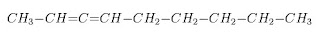




 2 - Aromáticas
2 - Aromáticas

